




L’équipe « Molécules Bioactives », grace aux différents groupes la constituant, s’intéresse à la synthèse de molécules aux propriétés antivirales ou
antitumorales, ainsi qu’aux outils biologiques (inhibiteurs, sondes de fluorescence, tests de diagnostic, etc) nécessaires pour l’étude de leur activité
in vitro. L’équipe développe également de nouvelles méthodes d’analyses immunologiques pour l’étude pharmacologique de molécules utilisées en thérapie
antivirale, et des nanovecteurs multifonctionnels utilisés notamment pour améliorer le transfert de gènes (thérapie génique) et/ou la thérapie cellulaire.
L’équipe (Site CNRS) travaille en particulier sur des thématiques orientées vers la conception et
l'application d’analogues de nucléosides et d’oligonucléotides en tant qu'outils thérapeutiques et biologiques. Une des activités importantes concerne le
développement d’outils pour étudier les interactions acides nucléiques/protéines. Notre approche est interdisciplinaire : la chimie des processus biologiques
est étudiée par des méthodes physiques (spectroscopie) en s’appuyant sur les compétences de chimie organique et de chimie biologique présentes dans l’équipe.
Un des défis majeurs de l’ère post-génomique et protéomique concerne la caractérisation et la quantification des interactions protéine/acide nucléique. En
plus des aspects fondamentaux de ces études, elles visent aussi à comprendre les bases moléculaires de diverses maladies et à établir des méthodes de diagnostic
et de criblage à haut débit. Pour atteindre ces objectifs, il faut néanmoins disposer de nucléobases sensibles aux changements environnementaux qui perturbent
à minima la structure et la fonction de ces acides nucléiques. Dans ce contexte nous avons exploré l’accès à de nouveaux outils basés sur différentes approches
de marquage des acides nucléiques et en particulier dans le développement de nouvelles sondes de fluorescence. Si vous souhaitez nous rejoindre, cliquez ici :
'Carrière' afin de nous soumettre votre candidature.
Les acides nucléiques et le développement de nouveaux outils sont au cœur de nos activités de recherche. Nous avons introduit un nouveau concept reposant
sur les propriétés de sondes fluorescentes à émettre à deux longueurs d’ondes pour un marquage interne et externe des acides nucléiques. Ces outils sont capables
de traduire avec une grande sensibilité les interactions acides nucléiques/protéines. Ce projet a été soutenu par une ANR blanche (2007-2011). Il s’inscrit dans
le cadre d'une collaboration avec le Pr. Yves Mély (  , - Faculté de Pharmacie, Strasbourg) pour les études photophysiques et d’interactions
avec les protéines, le Pr. Alexander Demchenko (Palladin Institute of Biochemistry, Kiev) et le professeur Vasyl Pivovarenko (
, - Faculté de Pharmacie, Strasbourg) pour les études photophysiques et d’interactions
avec les protéines, le Pr. Alexander Demchenko (Palladin Institute of Biochemistry, Kiev) et le professeur Vasyl Pivovarenko (  - Kiev National Taras Shevchenko, Chemistry Faculty) pour leur
expertise dans la chimie des sondes de fluorescence, et le Dr. Cyril Kenfack (
- Kiev National Taras Shevchenko, Chemistry Faculty) pour leur
expertise dans la chimie des sondes de fluorescence, et le Dr. Cyril Kenfack (  - Université de Douala) pour sa contribution dans les études de modélisation et de
calculs ab initio.
- Université de Douala) pour sa contribution dans les études de modélisation et de
calculs ab initio.
Notre expertise dans ce domaine nous a permis de proposer ces outils photophysiques pour étudier différents processus biologiques impliquant des interactions acides
nucléiques/protéines.
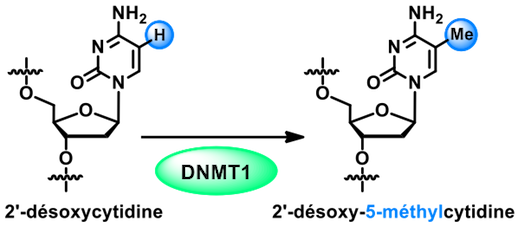
 , - Faculté de Pharmacie, Strasbourg). L'étude de la première étape de ce mécanisme épigénétique (la reconnaissance du double brin hémi-méthylé par le domaine SRA de UHRF1) a conduit à une publication dans l'excellent journal de chimie J. Am. Chem. Soc. en 2017.
, - Faculté de Pharmacie, Strasbourg). L'étude de la première étape de ce mécanisme épigénétique (la reconnaissance du double brin hémi-méthylé par le domaine SRA de UHRF1) a conduit à une publication dans l'excellent journal de chimie J. Am. Chem. Soc. en 2017.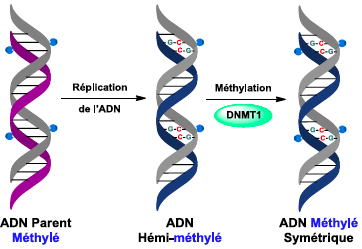
Un autre projet a été initié en collaboration avec le Pr. Olga Fedorova (  - Novosibirsk State University) qui s’intéresse à l’étude des mécanismes de réparation de l’ADN.
Une meilleure compréhension de ces mécanismes constitue un sujet d’importance pour les Sciences du Vivant et la santé humaine. Ce projet est soutenu par la région PACA
au travers d’un projet exploratoire (2014-2015) et a conduit à la publication de trois articles (PlosOne 2014, Russ. J. Bioorg. Chem. 2019 (1), Russ. J. Bioorg. Chem. 2019 (2)). Nous nous sommes également intéressé au mécanisme de Transcription Inverse du VIH (Chem. Eur. J. 2018). Enfin, nous avons également étudié l'organisation des lipides au sein des membranes cellulaires (ACS Chem. Biol. 2017).
- Novosibirsk State University) qui s’intéresse à l’étude des mécanismes de réparation de l’ADN.
Une meilleure compréhension de ces mécanismes constitue un sujet d’importance pour les Sciences du Vivant et la santé humaine. Ce projet est soutenu par la région PACA
au travers d’un projet exploratoire (2014-2015) et a conduit à la publication de trois articles (PlosOne 2014, Russ. J. Bioorg. Chem. 2019 (1), Russ. J. Bioorg. Chem. 2019 (2)). Nous nous sommes également intéressé au mécanisme de Transcription Inverse du VIH (Chem. Eur. J. 2018). Enfin, nous avons également étudié l'organisation des lipides au sein des membranes cellulaires (ACS Chem. Biol. 2017).
L'étude de ces mécanismes biologiques majeurs n'a été rendue possible que par l'extrême sensibilité de nos raporteurs fluorescents aux changements environnementaux (Chem. Eur. J. 2014, Chem. Eur. J. 2016), mais plus particulièrement l'hydratation environnante (RSC Adv. 2015, Dyes Pigm. 2019). L'incorporation de ces nucléosides fluorescents au sein d'oligonucléotides (ODNs) nous a par exemple permis d'étudier les changements conformationels de l'ADN, communéments rencontrés lors d'intéractions nucléo-protéiques; la conversion de simples brins à doubles brins d'ADN 'B' et/ou 'A' (J. Mater. Chem. C 2015) mais également les mésappariements (RSC Adv. 2016). Le transfert d'énergie par résonance de type Förster (FRET) est également une technique majeure pour étudier ces intéractions biologiques. C'est pour cela que nous travaillons également sur le dévelopement de 'donneurs' particulièrement photostables présentant un déplacement de Stokes supérieurs à 100 nm, aussi appelé 'Méga-Stokes' (J. Org. Chem. 2016).